2006/11/22(Wed)
 国立感染症研究所などのグループが学会で報告したところによると、院内感染菌「クロストリジウム・ディフィシル」(Clostridium difficile)の変異株が、国内で初確認されたという。
国立感染症研究所などのグループが学会で報告したところによると、院内感染菌「クロストリジウム・ディフィシル」(Clostridium difficile)の変異株が、国内で初確認されたという。
この変異株は、北米やヨーロッパの病院や高齢者施設などで広がっているもので、これまでの「クロストリジウム・ディフィシル」より、数倍の毒性を持つものである。
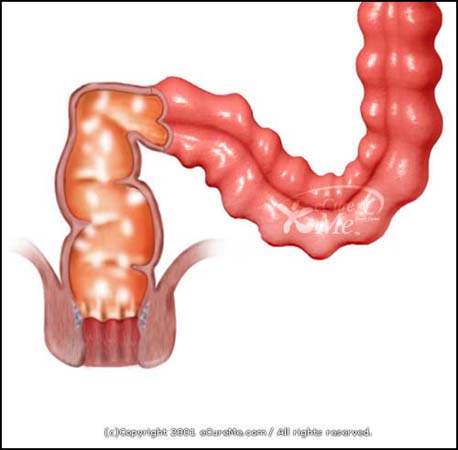
通常のクロストリジウム・ディフィシルは新生児の糞便中で約半数程度に認められ、その存在自体で、消化器症状をみることはないのだが、抗生物質の投与によって、腸内細菌叢が変化し、菌交代によって増殖を始め、トキシン-A、トキシン-Bと呼ばれる毒素を産生し、この、トキシン-A(A-toxin)が産生する毒素(エンテロトキシン−enterotoxin −)と、トキシン-B(B-toxin)が産生する毒素( サイトトキシン-cytotoxin-)が腸管粘膜に障害を起こし、クロストリジウムディフィシル関連腸炎(CDAD:Clostridium difficile associated. diarrhea、偽膜性大腸炎 pseudomembranous colitis (PMC))に至ることがある。
偽膜(pseudo=偽の、membranous=膜形成性の)とは、本来の粘膜が壊死して、壊死細胞片、浸潤細胞、線維素から成る偽の膜で覆われることから、この名前がついている。
この場合、トキシン-Aも、トキシン-Bも、炎症カスケードを活性化させる役割を、ともに持つが、トキシン-Aは、細胞間の結合を崩壊させる役割を持ち(腸管毒素)、その結果、分泌液の増加、粘膜損傷、浮腫、腫脹の発生を起こし、トキシン-Bは、細胞骨格破壊の役割を持つ(細胞毒素)、とされている。
このトキシンの産生をコントロールするものとして、tcdC遺伝子(toxin regulator gene)というものがあるのだが、近時、発見されたクロストリジウム・ディフィシル(PCR ribotype 027(toxinotype III))では、この、tcdC遺伝子が変異しており、毒素産生を制御しているtcdC遺伝子内の塩基配列に18bp(bp=塩基対=はDNAの長さの単位、base pair)が欠失(18-bp deletion)しており、このためトキシンの産生をコントロールすることができないため、トキシン-A、トキシン-Bの産生がそれぞれ16、20倍に増加していることがわかっている。
このクロストリジウム・ディフィシルには、トキシンA(遺伝子名は、tcdA)、トキシンB(遺伝子名は、tcdB,)にくわえ、第3の毒素と言われるバイナリー・トキシン(binary toxin、ADP-ribosyltransferase 、ADPRT、遺伝子名はcdtA/cdtB)が産生しているもので、これをトキシノタイプIIIとして、分類している。
参考「Novel multiplex-PCR method for simultaneous detection of Clostridium difficile toxin A and toxin B and the binary toxin (cdtA/cdtB) genes applied on a Danish cohort」
そのほかに、大腸菌16S rDNA遺伝子(rRNA−リボゾーム(Ribosome) RNA(リボ核酸)−は、大きさによって23S,16S,5S rRNAに分類され、それをコードするのが rDNA遺伝子 )も毒性に関与している。
今回、国立感染症研究所などが発表のクロストリジウム・ディフィシルも、この毒性の強い、「PCR ribotype 027(toxinotype III)」とよばれるものとみられる。
この、「PCR ribotype 027(toxinotype III)」は、こちらのサイト「Table 2. Correlation of toxinotyping with other typing methods」によれば、
ToxinotypeがIIIで
Serogroup(血清群)がA1, A5, G で
Ribotypeが027、034、075、080あるうちの027ということになる。
このクロストリジウム・ディフィシル(Clostridium difficile)というのは、どこの国でも、やっかいなものとなっているようだ。
クロストリジウム・ディフィシルが出現したのは、1978年であり、それは、clindamycin(クリンダマイシン、日本での商品名はダラシンS、クリダマシン、パナンコシン、ハンダラミン、ミドシン、モハマイシン、リンタシンSなど)に対する耐性菌としてであった。
その治療薬としては、1983年までは、経口服用の vancomycin(日本での商品名: バンコマイシン)が使われた。
しかし、多くの患者に対しては、このvancomycin服用は、効果があったが、25パーセントの患者に対しては、効かなかった。
そして、1983年から2003年にかけて、クロストリジウム・ディフィシルは、cephalosporins(セファロスポリン、日本での商品名は、セファメジン、セファトレキシールなど多数、セフェム系抗生物質 は、第一世代セフェムから第三世代セフェムまである。)耐性菌となった。
この治療に使われたのは、metronidazole(メトロニダゾール、日本の商品名は、フラジールなど)であった。
しばらくは、このmetronidazoleがクロストリジウム・ディフィシル治療の標準になったが、2003年から、今回のようなクロストリジウム・ディフィシル変異株の出現によって、新たな治療方法が、模索されつつある。
参考「The New Epidemic of Clostridium difficile–Associated Enteric Disease」
もっとも、このサイト「Clostridium difficile PCR ribotype 027, toxinotype III in the Netherlands」でのオランダのPCR ribotype 027クロストリジウム・ディフィシル変異株治療例では、これまでのmetronidazoleに代わって、再び、vancomycinでの治療を施しているとの記述もみられる。
これらの抗生物質とクロストリジウム・ディフィシルとの追いかけごっこの動きとは別に、新たな視点から、クロストリジウム・ディフィシル対策を講じようとする動きもある。
このサイト「ImmuCell’s Milk Immunoglobulin Technology」では、ドナー牛の初乳からとった DiffGAMという製品(IMMUCELL CP社製)が、耐性化してきかなくなった抗生物質の代わりに、CDAD (クロストリジウム・ディフィシル関連下痢症、Clostridium difficile associated colitis) に効くとしている。
初乳に含まれる免疫グロプリンが、効果的のようだ。
これについては、このサイト
「Colostrum」もご参照
参照
「Clostridium difficile Toxins: Mechanism of Action and Role in Disease」
「Characterization of a toxin A-negative, toxin B-positive strain of Clostridium difficile.」
http://www.biomerieux.com/upload/api_news_no.14.pdf
「Clostridium difficile PCR ribotype 027, toxinotype III in the Netherlands」
「Molecular Analysis of Clostridium difficile PCR Ribotype 027 Isolates from Eastern and Western Canada」
为翻译对汉语, 使用这
⇒http://translate.livedoor.com/chinese/
Translate
⇒http://www.google.com/translate_t
笹山登生HOME-オピニオン-提言-情報-発言-プロフィール-掲示板-ご意見